 2023-06-13 环球过滤分离技术网 guolvfenlitech6 目的探讨聚醚砜(PES)滤芯对舒血宁注射液生产质量的影响。方法对过滤前后的滤芯进行完整性测试,电镜分析,溶出物分析及不挥发性残留物测定,并测定总黄酮含量及指纹图谱。结果与结论过滤前后的滤芯泡点,电镜图无明显差异,可能引入舒血宁注射液的溶出物有聚乙烯吡咯烷酮、己内酰胺和聚乙二醇,但放大至工艺批量时溶出物浓度很低,可忽略,1支10英寸的PES滤芯的不挥发性残留物不会超过0.161 0 g。过滤过程对舒血宁注射液的总黄酮含量及指纹图谱无明显影响。PES滤芯对舒血注射液生产质量无显著影响。 关键词:聚醚砜滤芯;舒血宁注射液;溶出物;影响 膜过滤技术已被广泛应用于制药行业,是制药纯化、无菌保证过程的重要手段[1-2]。对于液体过滤,除菌滤芯的膜材的标称孔径一般为0.22 μm,且1 cm2有效过滤面积在工艺条件下可对缺陷型假单胞杆菌(Brevundimonas diminuta,ATCC19146)截留107CFU[3]。除菌滤芯的膜有亲水和疏水之分,一般的液体无菌制剂产品溶剂均为注射用水,故选择亲水性除菌滤芯。聚醚砜(PES)滤芯的优点是具有独特的亲水性滤膜结构,孔径分布均匀,孔隙率高,且具有广泛相容性,耐酸、耐碱性能好,故多数无菌制剂的终端除菌过滤均选择PES除菌滤芯。但需注意的是,2010年版《药品生产质量管理规范》规定,与药品直接接触的生产设备表面应当平整、光洁、易清洗或消毒、耐腐蚀,不得与药品发生化学反应、吸附药品或向药品中释放物质[4]。近年来,对与药品直接接触的包装材料、生产设备的研究越来越多,其中研究安瓿对药品的影响较深入具体[5-7],而同样是与药品直接接触的过滤器材的深入研究却鲜见报道。笔者研究了除菌过滤时使用的除菌滤芯对舒血宁注射液生产质量的影响,以探讨滤芯的理化变化,对产品的有效成分的吸附或截留情况及主要成分物质基础的变化情况。 1 仪器与试药1.1 仪器 CPA225D型电子天平(赛多利斯科学仪器<北京>有限公司);PHS-3C型pH计(上海理达仪器厂);Palltronic FlowstarⅣ型自动完整性测试仪(颇尔过滤器<北京>有限公司);VE-9800型电子显微镜(基恩士<中国>有限公司);LC-20A液相色谱仪(岛津<中国>有限公司);气质联用仪(赛默飞世尔科技<中国>有限公司)。 1.2 试药 PES滤芯(科百特过滤器材有限公司,规格为10英寸,批号为CO0913092441,CN2813082762,CN1078561603)。舒血宁注射液(神威药业集团有限公司,批号为150526C1,150527C1,150528C1,规格每支5 mL)。甲醇、乙腈为色谱级,其他试剂为AR级。芦丁对照品(中国食品药品检定研究院,批号为100080-200707);银杏叶对照提取物(中国食品药品检定研究院,批号为110866-201204)。 2 方法与结果2.1 方法 2.1.1 除菌滤芯处理 选择3支除菌滤芯,分别过滤舒血宁注射液,过滤后的滤芯用5%氢氧化钠溶液浸泡5 min后,用70℃注射用水冲洗30 min后备用,过滤前后的舒血宁注射液备用。 2.1.2 滤芯泡点测定 采用PALL完整性测试仪测定滤芯使用前后的泡点值,仪器参数设置为:测试压力2 750 mbar,测试时间600 s,最小泡点值3 400 mbar,最大压力6 000 mbar。 2.1.3 滤膜电镜分析 过滤前从一根滤芯中取出部分滤膜,使用后从另一根滤芯中取出部分滤膜,用电子显微镜分别测试,观察滤膜表面有无明显侵蚀痕迹,滤膜孔径有无明显变化。 2.1.4 溶出物分析 将1支经前处理的滤芯置于专用抽提装置中,加入1 500 mL模拟溶剂20%乙醇-80%纯化水(pH=2.98)在50℃下往复抽提24 h,所得溶液为溶出液。对溶出液进行高效液相色谱(HPLC)法分析和气相色谱-质谱(GC-MS)法分析。 2.1.5 不挥发性残留物(NVR)测定 取溶出液750 mL,减压浓缩至50 mL后,再转移至预先恒重的称量瓶中,于105℃干燥至恒重,测定每支滤芯的不挥发性残留物。 2.1.6 总黄酮醇苷含量及指纹图谱测定 参照舒血宁注射液质量标准中总黄酮醇苷和指纹图谱项下方法[8]测定。 2.2 结果 2.2.1 过滤前后泡点 该型号的滤芯合格泡点值为≥3 200 mbar。由表1可见,完整性均符合要求,且过滤前的相对偏差均在±5%范围内,较稳定、可靠。 [size=0.8em]表1 过滤前后滤芯的泡点  2.2.2 滤膜电镜分析 由图1可见,使用后滤膜表面无明显侵蚀痕迹,膜孔径亦无明显变化。 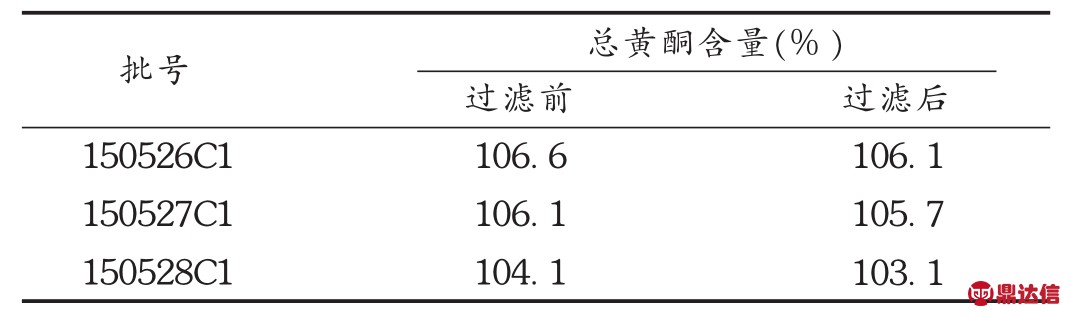 [size=0.8em]图1 使用前后滤膜的扫描电镜对比图 2.2.3 溶出物分析 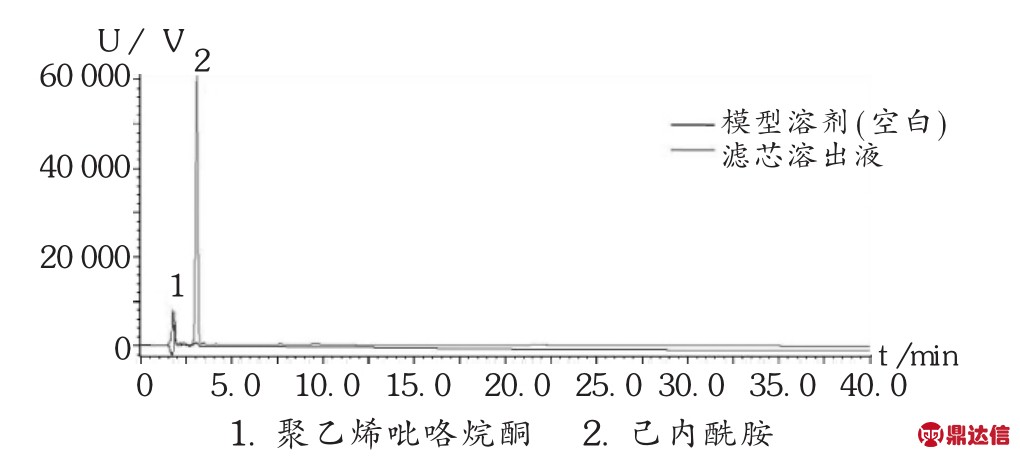 [size=0.8em]图2 PES滤芯在模拟溶剂(20%乙醇-80%纯化水,pH=2.98)中的溶出物RP-HPLC图 HPLC分析:由图2可知,测试用的PES滤芯在模拟溶剂(20%乙醇-80%纯化水,pH=2.98)中往复抽提条件下,向溶剂体系中释放的溶出物主要有两种,根据滤芯生产过程中的添加成分,采用保留时间比对的方法,对这个溶出峰进行初步定性为聚乙烯吡咯烷酮(RT=1.714 min)和己内酰胺(RT=3.070 min)。由图3可知,两支不同批次的滤芯溶出物完全一致。 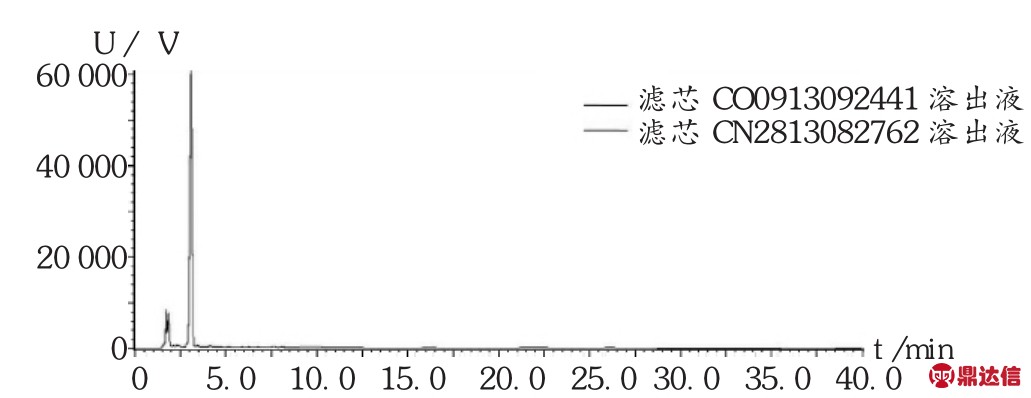 [size=0.8em]图3 两支不同批次滤芯的溶出物RP-HPLC图 [size=0.8em]表2 PES滤芯在模拟溶剂(20%乙醇-80%纯化水,pH=2.98)中的溶出物初步定性结果汇总表 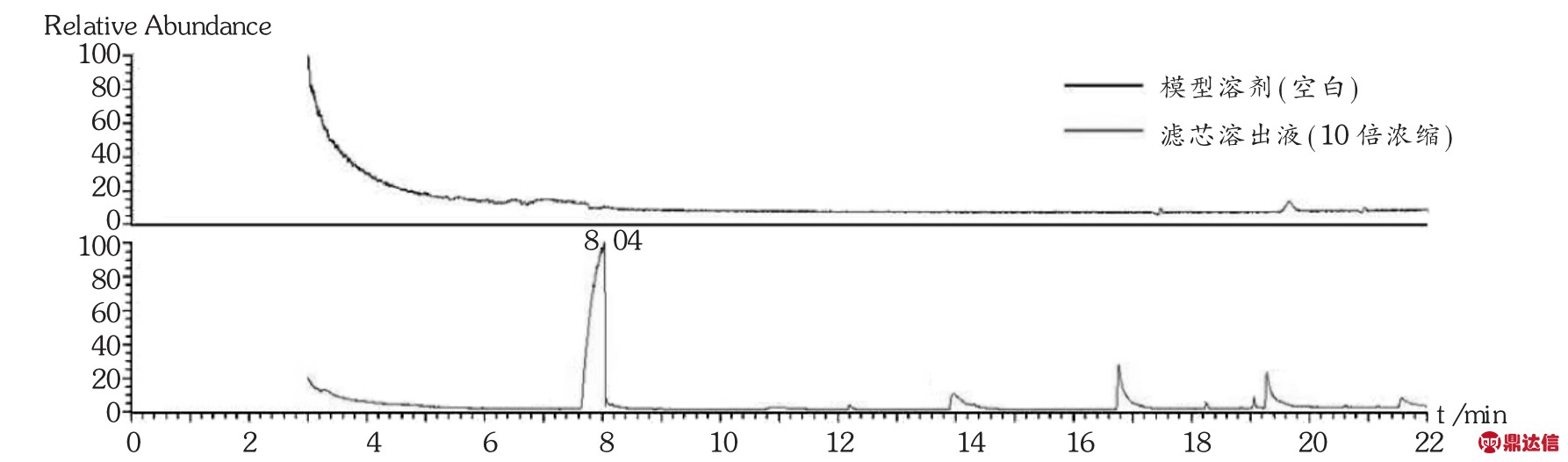 GC-MS分析:对比空白溶剂与滤芯溶出液(10倍浓缩)GC-MS分析图(图4),滤芯溶出液中出现6个可辨认峰,可能的主要溶出物为己内酰胺和聚乙二醇,其中RT为10.91,13.96,16.77,19.29,21.57 min的均为聚乙二醇分子断裂而成的化合物,即测试的主要溶出物确定为己内酰胺和聚乙二醇。  [size=0.8em]图4 PES滤芯在模拟溶剂(20%乙醇-80%纯化水,pH=2.98)中的溶出物(10倍浓缩)GC-MS分析TIC图 为了确认在实际生产过程中溶出物浓度很低,用GC-MS再次对稀释至工艺批量的溶出液进行分析。由图5可见,在GC-MS分析检测限条件下,稀释至工艺批量的溶出液中已不存在GC-MS可检测到的物质,即使溶出最多的己内酰胺的浓度也低于检测限(0.01 ppm),说明实际生产中溶出物浓度很低,可忽略。 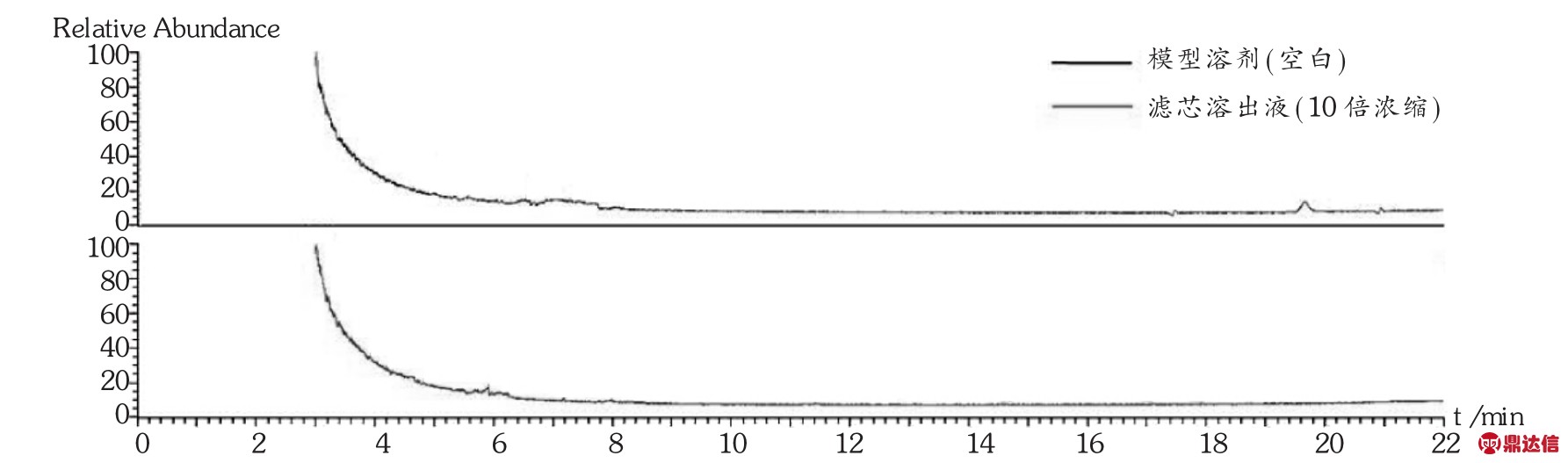 [size=0.8em]图5 稀释至工艺批量的溶出物GC-MS分析TIC图 2.2.4 不挥发性残留物(NVR) 1支10英寸PES材质SPSH-SM 0.22 μm滤芯在用20%乙醇-80%纯化水(pH=2.98)作为模拟溶剂时,溶出总量不会超过0.161 0 g。见表3。 [size=0.8em]表3 NVR分析结果  2.2.5 总黄酮含量与指纹图谱 由表4和图6可知,过滤前后舒血宁注射液的总黄酮含量无显著变化,以过滤前为标准图谱,过滤后的指纹图谱与过滤前的图谱比对,其相似度分别为0.999,0.998,0.999,说明过滤时滤芯对舒血宁注射液的黄酮类成分的物质基础无明显影响。 [size=0.8em]表4 过滤前后舒血宁注射液总黄酮含量变化  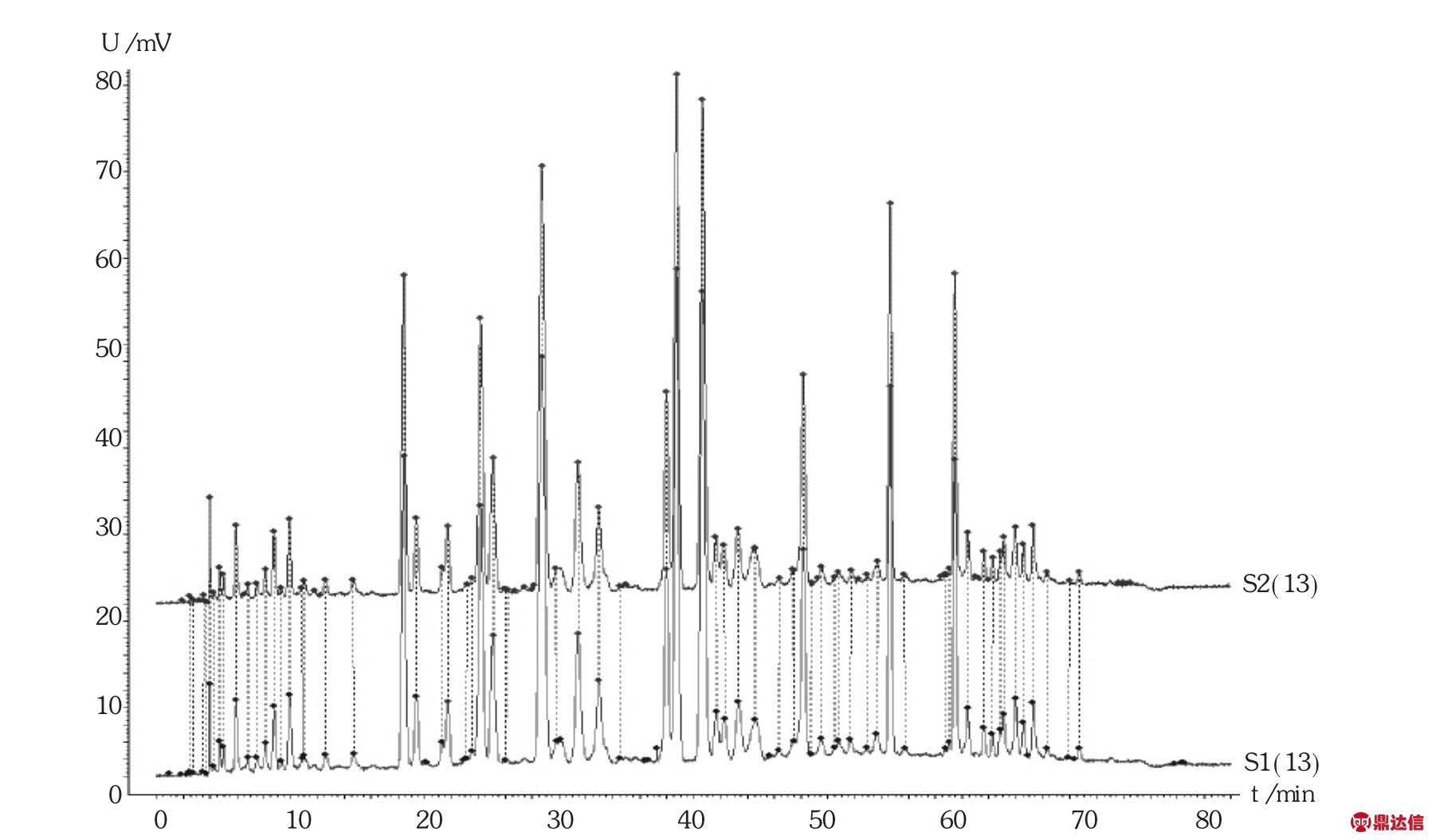 [size=0.8em]图6 舒血宁注射液指纹图谱对比 [size=0.8em]注:S1为150526C1过滤前,S2为150526C1过滤后 3 讨论 3.1 模拟溶剂选择 在溶出物分析时,理想情况下,最好使用实际药液作为提取介质,但实际药液组分对分析过程产生干扰时,应使用最接近实际产品的模型溶剂[9]。本研究中采用了模拟溶剂提取法,同样是避免产品组分的干扰。由于舒血宁注射液的黄酮有效成分及辅料中含有羟基及多羟基醇类物质,最低的pH可达到3.0,且注射液的总固体与纯化水的比例约为20∶80,因此最终模拟溶剂选择为pH=2.98的20%乙醇-80%纯化水。 3.2 溶出物考察 通过采用HPLC及GC-MS方法对溶出物分析,最终初步确定,PES滤芯可能引入舒血宁注射液的成分有聚乙烯吡咯烷酮、己内酰胺和聚乙二醇,说明滤芯的清洗程序及与药液接触的时间及批量的重要性,均应严格控制,以防止滤芯溶出物的积累。 3.3 不足 过滤前后指纹图谱分析时,受大类成分分析条件的影响,本文仅针对舒血宁注射液代表的有效成分黄酮类物质进行比较,无明显影响,而黄酮类成分仅占舒血宁注射液总固体的25%~30%,对其他固体物的影响仍需进一步研究分析。 来源于:网络,侵权告删 www.guolvfenlitech.com |

扫一扫,关注我们
Copyright©2016-2036 www.guolvfenlitech.com 环球过滤分离技术网All Rights Reserved.
免责声明: 本网不承担任何由内容提供商/者提供的信息所引起的争议和法律责任!
GMT+8, 2026-3-8 14:45 , Processed in 0.111520 second(s), 13 queries , File On.